Липосомы - что это такое?
Липосомальные технологии в медицине, дерматологии и косметологии
 В середине 60-х годов английский ученый Алек Бэнгхем, выясняя роль фосфолипидов в свертывании крови, изучал структуру коллоидных дисперсий, образующихся при набухании фосфолипидов в избытке воды. На электронных микрофотографиях он увидел слоистые частицы, удивительно похожие на мембранные структуры клетки [34,35]. Следующее исследование показало, что неорганические ионы, присутствующие в растворе в момент набухания фосфолипидов, включаются внутрь этих частиц и удерживаются там длительное время, обмениваясь с ионами наружного раствора с очень малой скоростью [12,16]. Так, впервые было установлено, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые мембранные оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего диффузии растворенных в ней веществ [12,16,32,31]. С момента открытия везикул и доказательства их инкорпорирующей и стабилизирующей способности в отношении многих веществ, в том числе и лекарственных, прошло более 40 лет.
В середине 60-х годов английский ученый Алек Бэнгхем, выясняя роль фосфолипидов в свертывании крови, изучал структуру коллоидных дисперсий, образующихся при набухании фосфолипидов в избытке воды. На электронных микрофотографиях он увидел слоистые частицы, удивительно похожие на мембранные структуры клетки [34,35]. Следующее исследование показало, что неорганические ионы, присутствующие в растворе в момент набухания фосфолипидов, включаются внутрь этих частиц и удерживаются там длительное время, обмениваясь с ионами наружного раствора с очень малой скоростью [12,16]. Так, впервые было установлено, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые мембранные оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего диффузии растворенных в ней веществ [12,16,32,31]. С момента открытия везикул и доказательства их инкорпорирующей и стабилизирующей способности в отношении многих веществ, в том числе и лекарственных, прошло более 40 лет.В 1974 году Грегори Грегориадис из Лондона предложил помещать внутрь этих везикул - липосом лекарственные препараты для их транспортировки в организме. Именно это и открыло новые перспективы применения липосом в медицине как носителей лекарств [12,24].
Все эти годы липосомы (от греч. липос – жир и сома – тельце или частица) интенсивно исследуются и применяются в качестве моделей мембран, транспортных контейнеров, а также реакционных систем в биохимии, фармации, иммунологии и биотехнологии. Некоторые липидные везикулы получили специальные названия, например, «протеолипосомы», «иммуносомы», «наносомы», «виросомы» и др. Последние используют в качестве искусственных вакцин. Термин «фармакосомы» был предложен для липосом с ковалентно присоединенными лекарственными веществами, т.е. из амфифильных предшественников лекарственных препаратов [3,16].
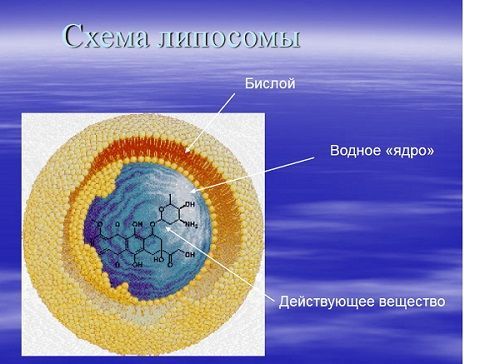
Итак, липосомы - сферические везикулы с одним или несколькими сплошными бислоями из фосфолипидов, например, из лецитина. Образуются везикулы благодаря способности многих нативных или синтетических соединений (церамиды, жирные кислоты, лизолипиды, а также неионогенные и ионогенные ПАВ и др.), обладающих амфифильными свойствами, в определенных условиях формировать замкнутые бислои [3].
Строение липосом, размеры, разновидности, химический состав
Основным и традиционным субстратом для образования липосом являются фосфолипиды, а из них - лецитин (фосфатидилхолин - эфир фосфорной кислоты и жирных кислот). Основная роль фосфолипидов в клетке – быть структурными компонентами мембран. Амфифильность придает фосфолипидам свойство самопроизвольно образовывать в воде мембраны, которые представляют собой двойной слой липидных молекул, обычно называемый липидным бислоем. Стремление максимально ограничить контакт неполярных цепей липида с водой приводит к тому, что бислой при его достаточной протяженности замыкается сам на себя, образуя полые оболочечные структуры, везикулы или липосомы [27,31,32].
Выбор лецитина как основного структурного компонента неслучаен. Он в сравнении с другими липидами обладает высокой степенью стабильности. Наличие водорастворимого и жирорастворимого участков обеспечивает ему свойства природного эмульгатора.
Липосомы из фосфатидилхолина формируются просто, их взвеси сохраняют стабильность в течение длительного времени. Кроме того, лецитин - природный антиоксидант, он также повышает пластичность мембран клеток, служит источником фосфора и жирных кислот, оптимизирует процессы усвоения многих БАВ.
Фосфолипиды являются основными составляющими мембран живых клеток, в том числе клеток кожи. Недостаток фосфолипидов приводит к серьезным изменениям обмена веществ, и, следовательно, к истощению, вялости, сухости кожи, нарушению ее функций, преждевременному старению. Использование фосфатидилхолина в составе двухслойных оболочек микрокапсул обеспечивает его наибольшую биодоступность [3,27].
Изготавливаются различные виды липосом. Чаще всего они являются многослойными, и потому их иногда называют мультиламеллярными везикулами (МЛВ). В их состав входят несколько десятков, а то и сотен липидных бислоев, разделенных водными промежутками. Такие частицы имеют довольно крупные размеры - до 5 мкм (5000 нм). На другом полюсе обширного липосомного семейства находятся самые маленькие везикулы (около 20 нм), образованные одним липидным бислоем и называемые малыми моноламеллярными везикулами (ММВ). Между этими двумя крайностями лежит целое поле разнообразных липосомных структур, различающихся размерами, формой, числом липидных бислоев и внутренним устройством. Внешне липосомы не всегда выглядят как глобулярные частицы. Иногда они принимают уплощенную дискообразную форму (так называемые дискомы) или имеют вид очень длинных и тонких трубок, которые называют тубулярными липосомами [13,25,36].
На терапевтическую ценность липосомальной системы как средства доставки лекарственных веществ значительное влияние оказывают размер липосом, строение липидного слоя и соотношение лекарство/липид. В качестве средств доставки используются три вида липосом: многослойные везикулы (диаметр 200-1000 нм), большие однослойные везикулы (50-200 нм) и малые однослойные везикулы (20-50 нм) [12,13].
Для производства чаще всего применяются три технологии получения липосом в различных модификациях. Две из них предусматривают солюбилизацию липидов в органических растворителях или детергентах, которые затем удаляются. Третья технология не требует применения солюбилизирующих веществ.
Эффективность той или иной технологии определяется по количеству инкапсулированного продукта, выраженному в процентах от общего объема лекарственных веществ в растворе [2,3,5,14].
Свойства липосом
Свойства липосом и их поведение определяются прежде всего наличием у них замкнутой мембранной оболочки. Несмотря на молекулярную толщину (около 4 нм), липидный бислой отличается исключительной механической прочностью и гибкостью. В жидкокристаллическом состоянии бислоя его компоненты обладают высокой молекулярной подвижностью, так что в целом мембрана ведет себя как достаточно жидкая, текучая фаза. Благодаря этому липосомы сохраняют целостность при различных повреждающих воздействиях, а их мембрана обладает способностью к самозалечиванию возникающих в ней структурных дефектов. Вместе с тем гибкость бислоя и его текучесть придают липосомам высокую пластичность. Так, липосомы меняют размеры и форму в ответ на изменение осмотической концентрации внешнего водного раствора. При сильном осмотическом стрессе целостность бислоя может нарушиться, и липосомы могут раздробиться на частицы меньшего размера [4,6,16].
Для практического применения липосом и везикул исключительно важна их способность включать в себя и удерживать вещества различной природы. Это может быть сделано разными способами. Круг веществ, включаемых в липосомы, необычайно широк – от неорганических ионов и низкомолекулярных органических соединений до крупных белков и нуклеиновых кислот. Хотя липосомы достаточно прочны и стабильны в широком диапазоне условий, их можно легко разрушить до мицеллярного состояния с помощью поверхностно-активных веществ, относящихся к разряду детергентов (то есть моющих средств). Этот процесс, называемый солюбилизацией, является обратимым, и липосомы вновь формируются, если детергент удалить из мицеллярного раствора. Самосборку мембран путем удаления солюбилизирующего детергента обычно применяют для встраивания интегральных мембранных белков в липидный бислой, называя этот процесс реконструкцией, а получаемые при этом белоксодержащие липосомы – протеолипосомами [5,19,25].
Формы взаимодействия липосом с мембраной клетки следующие: липосома может увеличить проницаемость мембраны – вызвать образование дополнительных каналов; может прикрепиться к мембране – адсорбироваться; важная форма взаимодействия – поглощение липосомы клеткой, в этом случае вещество, принесенное липосомой, попадает непосредственно в клетку; иногда клеточная мембрана и липосома обмениваются липидами, а в других случаях мембраны липосомы и клетки сливаются друг с другом (рис.2). При этом могут изменяться свойства клеточных мембран: например, их вязкость и проницаемость, величина электрического заряда. Может также увеличиться или уменьшиться количество каналов, проходящих через мембраны. Таким образом, благодаря липосомам появляется новый способ направленного воздействия на клетку, который можно назвать «мембранной инженерией» [25,27,31,36].
Применение липосом
Первое применение липосом в научных исследованиях было связано с моделированием клеточных мембран. С их помощью были установлены основные закономерности транспорта веществ через мембрану, показана важная роль фазовых переходов в функционировании мембран, определены молекулярные параметры липидного бислоя и его динамические характеристики, изучены процессы слияния мембран, в реконструированных системах были охарактеризованы индивидуальные мембранные белки и целые белковые ансамбли [16]. В последнее время на липосомы и везикулы обратили внимание представители других фундаментальных наук. Математиков интересуют проблемы топологии двумерных поверхностей в трехмерном пространстве в связи с упругими свойствами липидного бислоя. Физиков липосомы привлекают как фрактальные системы со специфическим поведением при агрегации и богатством морфологических превращений. Для химиков бислойные везикулы интересны как микрореакторы, позволяющие проводить химические реакции в ориентированных средах с возможностью пространственного разделения реагентов и продуктов реакции посредством мембран. Специалистам в области материаловедения липосомы представляются прекрасной основой для создания новых композитных материалов с высокой биосовместимостью [25,27]. В настоящее время некоторые фирмы выпускают специальные липосомные реагенты для трансфекции, то есть введения ДНК, РНК и других макромолекул в клетки разного типа, в т.ч. и растительные. Заслуживает упоминания также их использование для диагностических и аналитических целей. В липосомы можно включать радиоактивные, рентгеноконтрастные, парамагнитные вещества, а также вещества, отражающие ультразвук, с тем, чтобы улучшить качество изображений, получаемых такими методами диагностики, как компьютерная томография, рентгенография, сцинтиграфия и ультразвуковое зондирование [1,2,10,30]. Этот перечень можно продолжить, но и так ясно, что липосомы и везикулы в качестве объекта исследования обещают в будущем много интересных открытий. В настоящее время наиболее активно развивающееся направление практического использования липосом лежит в сфере фармакологии и медицины. Способность липосом включать в себя самые разные вещества практически без каких-либо ограничений в отношении их химической природы, свойств и размера молекул дает поистине уникальные возможности для решения целого ряда медицинских проблем [25,26,31].
Так, многие лекарственные препараты имеют низкий терапевтический индекс, т.е. лечебная доза мало отличается от токсичной. В других случаях лекарственный препарат при введении в организм может быстро терять активность под действием инактивирующих агентов. Включение таких препаратов в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен ее мембраной от действия неблагоприятных факторов, а с другой – та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого препарат высвобождается постепенно, в нужных дозах и в течение требуемого промежутка времени [22,32,33].
С точки зрения биологической совместимости липосомы идеальны как переносчики лекарственных препаратов. Они производятся из природных липидов и поэтому нетоксичны, не вызывают нежелательных иммунных реакций и биодеградируемы, то есть разрушаются под действием ферментов, присутствующих в организме. Однако, липосомы недостаточно стабильны в крови и тканях. Быстро захватываются и выводятся ретикулоэндтелиальной системой. По этой же причине липосомные носители обычно не удается направить именно в те органы и ткани, где происходит патологический процесс. Однако, привлекательность идеи липосомальной терапии была настолько велика, что перечисленные осложнения стимулировали многочисленные и интенсивные исследования, в результате которых для многих проблем были найдены оригинальные, а порой и остроумные решения.
Так, естественная нацеленность макрофагов на липосомы может быть использована для их активации, что очень полезно для борьбы с вирусными, бактериальными и грибковыми инфекциями и особенно в коже. Тот факт, что липосомы не задерживаются такими органами, как сердце, почки, мозг, а также клетками нервной системы, позволяет за счет использования липосомных лекарственных форм значительно снизить кардиотоксичность, нефротоксичность и нейротоксичность дорогостоящих препаратов, применяемых для противораковой терапии. Кроме того, прикрепление к поверхности липосом молекул, специфичных по отношению к клеткам-мишеням (например, иммуноглобулинов), в некоторых случаях оказывается эффективным для направленной доставки соответствующих лекарств. Проблема доставки лекарства в нужное место может быть также решена путем местного применения липосомсодержащих лекарственных средств, как это было сделано в случае противоартритных и проитивоастматических препаратов, а также для лечения дыхательного синдрома новорожденных [11,19,21,23].
Все эти приемы были предложены для обычных липосом, время пребывания которых в кровотоке невелико (от нескольких минут до нескольких часов). И поэтому они не решали общей проблемы преодоления естественных барьеров для липосом в организме, основным из которых является печень. Проблема была решена за счёт увеличения гидрофильности при помощи ковалентно связанного синтетического полимера полиэтиленгликоля [3]. В результате время жизни липосом в кровотоке превысило двое суток. Но, что более важно, такие липосомы постепенно накапливались в тех местах, где кровеносные сосуды были фенестрированы, обладали повышенной проницаемостью или вообще были плохо развиты, что обычно характерно для опухолей и окружающих их тканей, а также при инфекционных и воспалительных процессах.
Необычные свойства полиэтиленгликольсодержащих липосом и их высокая терапевтическая эффективность были настолько велики, что эти липосомы получили образное название "липосомы-невидимки" (stealth liposomes) [3,5,7,12].
Применение липосом в медицине не ограничивается традиционной химиотерапией. Липосомы более перспективны в сочетании с новым поколением лекарств, созданных благодаря успехам белковой и генетической инженерии. Генная инженерия основана на введении фрагментов ДНК в клетки, с целью производства нужных белков. Использование для этой цели липосом, содержащих лечебные гены, может оказаться полезным для терапии наследственных заболеваний, которые обусловлены дефектами генов [15,30]. С помощью липосом в организм могут быть также введены различные белки, в частности ферменты, с целью энзимотерапии и цитокины для коррекции иммунного статуса организма. Весьма серьезные работы ведутся по созданию гемоглобинсодержащих липосом (гемосом) с целью получения искусственных заменителей крови [3,36]. Больших успехов достигли учёные при помощи липосом в борьбе с инфекционными заболеваниями. Получены препараты для лечения лейшманиоза – заболевания, различными формами которого страдает около 100 миллионов человек. Липосомальная форма сурьмы подавляет размножение возбудителей болезни в клетках печени в сотни раз эффективнее, чем обычная, а токсическое действие на сердце и почки снизилось настолько, что позволило увеличить дозу препарата. Сходные результаты были получены и при лечении похожих на лейшманиоз грибковых заболеваний – криптококкоза и гистоплазмоза [5].
Другие исследователи, используя антибиотик гентамицин, заключенный в липосомы, получили такие же результаты против возбудителей бруцеллеза, причем опыты были проведены как на культуре клеток, так и на животных – морских свинках [33].
Формы взаимодействия липосом с клетками, во многом объясняют их способность преодолевать многие анатомические барьеры организма, в частности, стенки желудочно-кишечного тракта. Это обстоятельство было использовано для лечения сахарного диабета - инсулин в липосомах per os. Оказалось, что введение инсулина в липосомах вызывало снижение сахара в крови животных, ибо липосомы защищают этот гормон от разрушения желудочно-кишечном тракте. В настоящее время исследования в этом направлении продолжаются. Цель их – добиться возможности лечения диабета введением инсулина перорально, что будет большим подарком для больных этой тяжелой болезнью. Липосомы также используются для лечения болезни Паркинсона. Липосомный препарат в дозе, в 10 раз меньшей, чем раствор ДОФА, давал более выраженный антипаркинсонический эффект. Кроме того, действие липосомного препарата длится почти в три раза дольше, чем обычного раствора ДОФА [19,31].
Успехи в разработке и применении липосомных препаратов медицинского назначения велики. В настоящее время они является предметом пристального внимания со стороны многих фармацевтических компаний, которые инвестируют значительные средства в эту область.
По данным реферативного сборника "Изобретения стран мира", опубликовано более 670 патентных документов, явившихся результатом изучения липосом.
В этой области лидируют Япония, США, ФРГ, Франция, Великобритания, Швейцария.
Применение липосом в дерматологии и косметологии
Традиционные лекарственные формы, применяемые в наружной терапии кожных болезней давно получили заслуженное признание во всём мире и, несмотря на значительные успехи в производстве лекарств для парентерального применения, средства для наружного применения продолжают разрабатываться и совершенствоваться.
Но, при этом, в производстве и применении липосом, в отечественной фармации и дерматологии практически нет фармакопейных мазей, кремов, паст, болтушек и др. наружных липосомсодержащих лекарственных форм. Причём препараты для наружного применения позволяют избежать тех сложностей, с которыми сталкиваются разработчики лекарств для внутреннего введения.
Изучение проницаемости кожи началось с работ исследователя Homalle, опубликованных в середине 50-х годов ХIХ века [17]. В них было показано, что кожа состоит из нескольких слоев, имеющих разное строение и функции. Homalle впервые заявил о том, что эпидермис гораздо менее проницаем, чем дерма. Чтобы проникнуть внутрь кожи необходимо пройти узкие межклеточные промежутки. Поэтому крупные молекулы (белки, полисахариды) не в состоянии этого сделать. Кроме того, липиды, заполняющие эти промежутки представляют собой гидрофобную среду, не пропускающую водорастворимые соединения. Вместе с тем через липидный барьер легко просачиваются небольшие жирорастворимые молекулы компоненты масел и жиров. Насыщенные жиры впитываются плохо, смешиваясь с эпидермальными липидами, они делают их более жесткими и менее проницаемыми [9,13] Было разработано несколько математических моделей кинетики проникновения различных веществ через роговой слой и их дальнейшего распределения в эпидермисе [33]. Все эти исследования явились предпосылкой для создания в 60-х годах первых липосом.
Липосомсодержащие мягкие лекарственные формы по сравнению с традиционными мазями, кремами и гелями обладают большей проникающей способностью по отношению к коже и её придаткам, а потому являются более доступными для живых клеток и следовательно более эффективными [9].
Исследования показали, что липосомы активно реагируют с эпидермоцитами. Они легко проникают в кожу (вплоть до подкожной клетчатки) и усваиваются, взаимодействуя с белками кожи и липидами клеточных мембран. Они могут сливаться с клетками, перенося активные вещества внутрь, захватываться клетками, внося в них свое содержимое, обмениваться с клеткой липидами из своей оболочки [18].
В работах, посвящённых лечению раневого сепсиса путём аппликации липосомальных суспензий содержащих рифампицин, было показано, что применение липосомальных форм в качестве депо, с регулируемой кинетикой выхода инкапсулированных веществ, является весьма эффективным. Кинетика выхода лекарственных средств из липосом в окружающую среду определяется целым комплексом факторов, в частности, размером и структурой липосом, концентрацией и природой инкапсулированного вещества, зарядом и составом липидного матрикса, величиной рН, температурой и т. д. [19,33].
Положительные результаты, полученные при лечении стафилококкового сепсиса послужили основанием для экспериментальной оценки возможности применения липосом в виде аппликаций при экспериментальной раневой инфекции, вызванной стафилококком [19]. В ходе эксперимента было доказано, что рифампицинсодержащие липосомы вызывали в два раза более быстрое заживление, чем рифампицин, введенный в виде инъекции [19].
В 90-х годах был разработан ранозаживляющий и противовоспалительный крем «Альпика», содержащий фитокомплекс в липосомальной форме. Эффективность этого средства была подтверждена экспериментально. Установлено, что противовоспалительное и ранозаживляющее действие крема «Альпика» значительно эффективнее, чем у крема без липосом с таким же качественным и количественным фито составом.
В 2004 году Исмаилова Г.К. проводила сравнительное изучение противовоспалительного действия магнитоуправляемых липосом преднизолона, липосом с преднизолоном, магнитолипосом и 0,5% преднизолоновой мази при экспериментальном аллергическом дерматите. В ходе исследований автор отметила, что при применении магнитоуправляемых липосом преднизолона происходил направленный транспорт лекарства в очаг поражения, увеличивалась глубина проникновения лекарственного вещества за счет сочетанного действия магнитного поля и липосомальной формы преднизолона.
При использовании 0,5% преднизолоновой мази без липосом процесс формирования молодого эпидермального слоя происходил на 3-4 суток медленнее, чем при использовании магнитоуправляемых липосом преднизолона, и в результате заживления формировался келоидный рубец [4].
Китайскими учёными в 2003 году был изготовлен липосомальный гель интерримина для лечения рака кожи. Было показано, что проницаемость кожи для интерримина сходна при его применении как в составе липосомного, так и обычного геля. Однако удерживание липосомного геля интактной кожей было в 3,2 раза выше по сравнению с обычным [38].
Shigeta Y., Imanaka H. в 2003 г. с целью разработки улучшенного липосомального препарата, содержащего линолевую кислоту, для профилактики гиперпигментации кожи получили комплекс из соевого лецитина и линолевой кислоты. Для выяснения механизма действия препарата оценивали проникновение в кожу и длительность нахождения в ней линолевой кислоты вблизи меланоцитов. В результате проведённых исследований авторы сделали вывод, что липосомальная форма линолевой кислоты проникает в кожу лучше и задерживается в ней значительно дольше, чем без липосом [37].
Для улучшения репарации ДНК базальных кератиноцитов после ожогов, в т.ч. полученных под действием ультрафиолета, был разработан липосомальный препарат димерицин, который представляет собой фермент репарации ДНК Т4 эндокуклеазу V [19].
Применение липосом в медицинской косметологии
Значительно более широкие возможности в использовании достижений химии и гораздо большая свобода выбора в применении достижений современной науки, более мягкая цензура, скорость реагирования на требования современного рынка, позволили производителям косметической продукции далеко позади оставить своих коллег, работающих в области фармации, по крайней мере, в области производства мягких лекарственных липосомальных форм.
В 1987 году две известные косметические компании создали новый продукт, явившийся плодом усилий их исследовательских лабораторий. Это были липосомный гель "Каптюр" фирмы "Кристиан Диор" и крем для кожи под названием "Ниосомы" фирмы "Л'Ореаль" [22]. В последующие годы в продаже появилось несколько сот аналогичных продуктов. Почти каждая косметическая фирма считала своим долгом предложить покупателю изделия, изготовленные на основе липосом. И сегодня это, пожалуй, самая передовая в коммерческом отношении область их практического применения.
В России первые липосомальные кремы - гели линии "Геликс" с витаминами А и Е выпущены в 1992 году фирмой "Низар". Годом позже, на базе российской фармацевтической компании "Д. Мазай" совместно с НИИ СНДВ появился гель с липосомами "Revelle" [23,27].
В основе липосомного косметического бума лежат два обстоятельства.
Во-первых, медицинские требования к препаратам для наружного применения являются значительно менее жесткими, чем для парентеральных. Сроки внедрения таких лекарств от исследовательской лаборатории до потребителя занимают значительно меньшее время и обходятся производителю намного дешевле.
Во-вторых, для косметических целей пригодны достаточно простые липосомы, производство которых не требует сложного технологического оборудования и дорогостоящих исходных материалов.
В-третьих, сроки годности косметических препаратов редко превышают 12 месяцев. Различные виды эмульсий и гели стали первопроходцами в липосомной косметике в ассортименте которой имеются кремы для повседневного ухода за кожей, кремы, предотвращающие ее старение, средства для ухода за кожей после бритья, кондиционеры для волос, духи с длительно сохраняющимся запахом, губная помада, солнцезащитные кремы, средства для загара, грим, интимная и декоративная косметика. Основу всех этих препаратов составляет водная дисперсия липосом, как правило, многослойных, которые благодаря способности удерживать воду являются прекрасным увлажняющим агентом. Для усиления полезных эффектов в рецептуру вводят добавки различных биологически активных веществ, таких как витамины, антибиотики, белковые экстракты, фруктовые кислоты. Нередко продукция выпускается по принципу "сделай сам", когда покупателю предлагается липосомальная основа, в которую он по своему желанию может ввести нужные добавки [8,9,10].
Приведенные примеры показывают, что липосомы уже переходят в разряд продуктов крупномасштабного производства, требующего высокопроизводительного оборудования и ориентированного на дешевое и доступное сырье. Ясно, что такое производство не может быть построено на основе природных фосфолипидов, выделяемых, как правило, из пищевых продуктов. Решение проблемы состоит в использовании для этих целей не самих липосом, а искусственных везикул, изготавливаемых из синтетических амфифильных соединений [2,3,5].
Технологии производства липосом
Понятия "микрокапсулирование" и "микроинкапсулирование" вошли в косметическую и медицинскую практику недавно. Микрокапсулы - это искусственные "микроупаковки" для БАВ различной химической природы и смесевого состава. Микрокапсулы можно формировать с включением поверхностно-активных веществ (ПАВ) или без них, а сама по себе липидная фаза может быть достаточно многокомпонентной. Эти "транспортные средства" представляют собой либо замкнутые системы, окруженные оболочкой, либо открытые матричные системы. К первому типу относятся все виды липосом, к последнему - многие эмульсии и полимерные пористые частицы [5]. Достаточно новым направлением является формирование циклодекстриновых комплексов. Свойства циклодекстринов позволяют создавать и открытые, и замкнутые системы. В зависимости от размеров микрокапсулы можно условно подразделить на 2 основные группы: довольно крупные частицы до 3-5 мк (соизмеримы с бактериальной клеткой, хорошо видны в световом микроскопе) и очень мелкие до 0,1-0,5 мк (соизмеримы с вирусной частицей). Чаще используются наночастицы - эмульсионные, везикулярные или полимерные структуры, измеряемые в нанометрах (нм), идеальные системы для трансдермального транспорта БАВ. Их морфологию можно изучить с помощью электронного микроскопа, а размеры - с помощью наносайзера [5].
Действительно, липосомоподобные везикулы могут быть получены из большого числа самых разных органических веществ при условии, что их молекулы построены в соответствии с принципом амфифильности, то есть содержат группировки, обладающие сродством к воде, и области, имеющие гидрофобный характер. Такие синтетические везикулы, как и настоящие липосомы, сохраняют все свойства оболочечных структур, включая их морфологическое разнообразие, и во многих случаях могут прекрасно заменять липосомы, сделанные из природных материалов [3,5]. Этот факт показывает, что везикулярные структуры имеют гораздо более широкое распространение, чем ранее предполагалось. Более того, соблюдение принципа амфифильности позволяет получать везикулы не только в воде, но и в неполярных органических растворителях. Еще более удивительным представляется образование бислойных везикул из молекул, вообще не содержащих гидрофильных полярных головок. Этот случай демонстрирует более общий принцип амфифильности, определяемый как сочетание в молекуле сольвофильных и сольвофобных свойств, то есть сродства и "нелюбви" к растворителю [5,13]. Все это говорит о том, что мембранный принцип организации материи распространяется не только на живые объекты, но и на неживой мир. А это означает, что наука о липосомах и везикулах в будущем обещает еще много интересного как в научном отношении, так и с точки зрения практического применения сделанных в этой области научных открытий.
Одна из главных причин ограниченного применения липосом в качестве систем доставки активных ингредиентов лекарственных и косметических веществ заключается в их нестабильности и очень коротком времени жизни [3].
В настоящее время новые исследования привели к созданию липосом второго поколения (полимеризованный вариант), которые остаются стабильными в течение длительного времени даже в присутствии детергентов и органических растворителей [3].
По данным обзора «Polymerized Liposomes: Unique Carriers of Drugs, Catalysts, Other Agents», опубликованного исследовательской фирмой Technical Insights (США), эти полимеризованные липосомы с длительным временем жизни в XXI веке будут играть существенную роль для разработки новых технологий производства медикаментов, косметических средств, диагностикумов, пестицидов, красок и покрытий. Разработка технологии получения полимеризованных липосом предоставляет возможность замены ими липосом первого поколения и дает возможность разработки новых коммерческих областей применения. В зависимости от типа липида, условий полимеризации, продолжительности облучения и его интенсивности, метода приготовления водной дисперсии получают липосомы с молекулярной массой от 103 до 3x105, диаметром от нескольких десятков до нескольких сотен нанометров. По сравнению с обычными полимерные липосомы значительно стабильнее. Кроме того, полимерные липосомы, содержащие в своей структуре полиакриловые кислоты, сами обладают противовирусными свойствами [6,9,32].
Лечебная косметика, или космицевтика, предназначена для применения в качестве вспомогательного средства у пациентов, страдающих различными заболеваниями кожи, с целью ускорения процесса выздоровления и удлинения периодов благополучия. Для здоровых людей – космицевтика является средством профилактики многих заболеваний и укрепления естественного защитного барьера кожи. Следует отметить, что сегодня грань между фармацевтическими препатарами для наружного применения и космицевтикой во многом стёрта. И доказательств тому великое множество [32]. Некоторые из них мы позволим себе привести в качестве примера.
Интересные данные получены в совместных исследованиях учёными из Института физиологии растений и Института биохимии им. А.Н.Баха при изучении возможности регуляции процессов старения. В экспериментах в качестве геропротектора использовались липосомы из смеси лецитина и общей фракции липидов из томатов, введённые в состав гелевой основы. Установлено существенное замедление старения популяции клеток микоплазм. Отмечен выраженный положительный эффект данного комплекса при солнечных ожогах кожи животных и человека. Это обеспечило возможность создания косметического средства с использованием томатола и дельтостима.
Томатол (коммерческое название фракции липидов из томатов) содержит жирные кислоты, фосфолипиды и каротиноиды, в частности ликопин, который по активности в 6 раз превосходит β-каротин. Томатол - мощный антиоксидант и стабилизатор мембран клеток. Томатол был встроен в бислой везикул со сложным липидным составом на основе лецитина, а для заполнения внутреннего объема микрокапсул использовали гидрофильный стабилизатор клеточных мембран – дельтостим [29].
Этот принципиально новый препарат включен в состав везикул "Геля-бальзама репарирующего". Благодаря микроинкапсулированию и взаимоусиливающему действию компонентов геля (масло расторопши пятнистой, эфирные масла апельсина, жасмина и пр.) дельтостим содержится в нем в сверхмалых дозах по сравнению с рекомендуемыми для его использования в чистом виде [17]. Клиническую эффективность геля оценивали у больных при папуло-пастулезной форме акне; атопическом дерматите в стадии ремиссии; термических ожогах средней степени тяжести; солнечных ожогах легкой и средней степени тяжести с поражением больших участков кожи (спина, плечи, бедра). Кроме того, гель-бальзам использовали в качестве успокаивающего, противовоспалительного средства после проведения процедуры пилинга гидроксикислотами. Препарат оказывал выраженное противовоспалительное действие; свежие воспалительные элементы появлялись в значительно меньшем количестве, цвет лица нормализовался. При атопическом дерматите в стадии ремиссии гель-бальзам оказывал репарирующий и общеукрепляющий эффект, что было показано при клинических исследованиях, проведенных на кафедре госпитальной педиатрии Новосибирского медицинского института [17]. Полученные результаты позволили разработать для серии профессиональной косметики "ГЛИКОЛИМ" новое средство "Гликолим-01", в которое дополнительно включен комплекс гидроксикислот и в котором отсутствуют эфирные масла цитрусовых [17].
Итак, использование БАВ в косметических и профилактических средствах существенно расширяет показания к их применению и является одним из наиболее перспективных направлений.
Свойства липосом позволяют создавать биокомплексы направленного действия и использовать активные компоненты в минимальных количествах без потери эффективности готовой рецептурной формы.
Методика микроинкапсулирования дает возможность синтезировать высокоэффективные средства по уходу за кожей на основе липофильных соединений без ПАВ. Томатол и дельтостим, инкорпорированные в лецитиновые везикулы, оказывают выраженные репарирующий и регенерирующий эффекты благодаря своим антиоксидантным, мембраностабилизирующим и адаптогенным свойствам [17].
Одними из наиболее эффективных стали липосомальные крема, содержащие "антивозрастные" ферменты, предотвращающие старение клеток. Коэнзимы, достигшие глубоких слоёв эпидермиса, тормозят процессы увядания и убирают с кожи сеточку мелких морщин, которая появляется у каждого человека после 30 лет.
В 2002-2003 гг. Кузякова Л .М. проводила исследования по разработке и совершенствованию биотехнологических процессов в производстве липосомальных лечебно-косметических препаратов. В ходе этой работы было установлено, что использование в качестве биологически активных веществ суспензии липосом из липидов животного и растительного происхождения с включенным экстрактом лекарственных трав и витаминов обеспечивает повышение регенерирующих свойств крема за счет глубокого проникновения в кожу сбалансированного состава необходимых компонентов, быстрого их обмена с липидами мембран клеток кожи и пролонгированного действия активных компонентов [6,7]. С учетом фармакологической активности лекарственных трав подобрали фитокомпозиции для препаратов. В качестве структурообразующих и эмульгирующих компонентов применяли аммонийную соль редкосшитого сополимера акриловой кислоты и полиаллиловых эфиров пентаэритрита (ареспол) и полиэтиленгликоль в совокупности с параформом, нипагином, нипазолом и глицерином. Растительные масла для технологического процесса подбирали с содержанием ненасыщенных жирных кислот не менее 60-90%, так как сочетание их с витаминами А,Д,Е,К, экстрагированными из фитосбора, оказывает на кожу благоприятное питающее действие [8,10].
На основании разработанных методических подходов к конструированию липосом с комплексом фитоэкстрактов и технологических исследований составлена принципиальная блок-схема производства липосомальных гелей, которая позволяет рассматривать единые подходы к созданию технологии трансдермальных липосмальных фитогелей [9,10].
Для борьбы с нежелательными волосами Jaap de Leeuw предложил лазерную терапию в сочетании с включенным в липосомы меланином (Lipoxome).
Эффективность перманентного удаления волос коррелирует с цветом волос. Пациенты с белыми седыми и светло-русыми волосами практически не могут достичь перманентного уменьшения количества волос путем обычной лазерной или фототерапии. У таких людей хороших результатов можно добиться с помощью меланиносодержащих липосом на основе фосфатидилхолина (Lipoxôme®). Меланиносодержащие липосомы селективно направлялись в волосяные фолликулы и волосяные стержни мышей. Пренебрежимо малое количество доставленных молекул попадали в дерму, эпидермис или кровь, тем самым доставка вещества в фолликул действительно оказывалась селективной. Доставка меланина в волосяные фолликулы с помощью липосом была проведена и на коже головы человека, при этом было показано, что этим методом можно окрасить волосы меланином [19].
Однако, наряду с проблемой нежелательных волос существует и проблема облысения. Одно из эффективных средств от облысения - миноксидил - хорошо растворяется только в некоторых органических растворителях. Они слишком быстро испаряются с поверхности головы. Лекарство не успевает полностью всосаться и, большей частью, оседает кристалликами на голове, не только не принося пользы, но и причиняя понятные неудобства. Миноксидил в липосомах лишён этих недостатков и применяется для лечения гнездной алопеции [19]. Фирма «Liposome Technology, Inc.» (США) разработала липосомальную форму миноксидила на основе полимерных липосом для местного применения. Препарат может быть изготовлен в форме липосом, мицелл, эмульсий и микроэмульсий. В настоящее время фирма работает над повышением биодоступности готовых форм миноксидила, а также над повышением их косметической привлекательности [19].
Липосомальная косметика достаточно широко представлена как на зарубежном, так и на Российском рынке. Французская компания «Academie» разработала новую серию препаратов для коррекции фигуры, в которой проникновение БАД для похудения обеспечивается улучшенной системой доставки на основе липосомальных технологий – сферулентов, представляющих собой многослойные липосомы [19]. Научно-исследовательский центр Швейцарской фирмы «Milad – Opiz» включил в состав многих средств профессиональной косметики липосомы как средства для доставки активных компонентов.
В России одними из известных компаний, производящих транспортные системы для доставки косметических препаратов являются лаборатория «Низар» (г. Москва) и НПО «Пульс» (г.Ставрополь). Липосомы, которые предлагают использовать в качестве компонентов в косметической промышленности, различаются составом липидов и размером, а также биодобавками. Часто их торговое название созвучно названию фирмы-производителя (например, ровисомы (Rovi, Германия), драгосомы (Dragoco, Австрия), низасомы («Низар», Россия) или названию серии продукции - альпосомы из серии косметики «Альпика» НПО «Пульс» (Россия). Но встречаются и другие варианты, например, сферосомы, дермасомы, ниосомы и т.д.
Фирмы LifeCore Biomedical (США) и MediControl (отделение компании Biotechnology Development Corp., США) ведут разработку нерецептурного продукта нового поколения для увлажнения кожи. Это липосомальный продукт с гиалуроновой кислотой. Фирмой Fountain Pharma (штат Флорида, США) разработана формула липосомального солнцезащитного средства 20-SPF UVB. Было показано, что солнцезащитный фактор (SPF-20) удерживался на коже в течение 8 часов, во время которых обработанные участки кожи подвергались действию 16 тридцатиминутных вихревых ванн. Кроме того, не отмечено никаких побочных действий препарата. Солнцезащитное средство не содержит масел и парааминобензойной кислоты. Липосомальная технология может со временем быть применена для включения в липосомы широкого ряда солнцезащитных средств. Результаты предварительных исследований показали, что солнцезащитные средства, содержащие липосомы, могут обладать повышенной проницаемостью в кератинизированный эпителий кожи. Такая улучшенная проницаемость повышает устойчивость кожи к воде и уменьшает необходимость частого применения [19].
Фирма «University Genetics Co.» (США) предоставила компании «L'Oreal» (Франция) лицензию на препарат генноинженерного фактора, задерживающего старение кожи (TSF). Лабораторные исследования показали, что препарат увеличивает продолжительность жизни клеток кожи. Японская компания «Kanebo» разработала новый косметический материал UV Microcapsule, который способен повышать эффект косметических средств и защищать от ультрафиолетового облучения. Материал разработан совместно с фирмой «Dainippon Ink & Chemicals» с использованием технологии микрокапсулирования. Косметическая фирма «BioEurope» (Франция) проводит разработку олигопептидов против старения кожи по новой технологии ферментативного синтеза на основе малилтирозина и сфинголипидов. L-тирозин - биосинтетический предшественник меланина - ввиду низкой растворимости не может непосредственно использоваться в дерматологических средствах наружного применения. Фирмой BioEurope во всех странах мира запатентован процесс получения малилтирозина энзиматической конденсацией L-яблочной кислоты и аминогруппы L-тирозина. Растворимость малилтирозина в 1000 раз выше, чем L-тирозина. Он может применяться в кремах для загара. Ряд новых продуктов уже поступил в продажу. Компанией также разработаны методы экстракции и очистки сфинголипидов животного происхождения от ганглиозидов, вызывающих аллергические реакции при применении липосом на основе липидов. Эти липосомы используются во многих косметических и дерматологических препаратах для доставки активных ингредиентов. Разработка метода получения новых фосфолипидов с использованием микробных материалов позволила фирме BioEurope начать продажи во Франции липосом "второго поколения" [19].
В Японии и США ведутся интенсивные исследования потенциальных свойств хитозана. Известно, что катионный характер полимера и наличие потенциально реактивных групп в хитозане обеспечивают уникальные свойства для технологий контролируемого высвобождения. Выявлено также, что хитозан может найти применение в качестве стабилизатора липосом. В липосомальной суспензии хитозан образует покрытие фосфолипидных мембран и действует как криопротектор, что продлевает срок хранения липосомальных препаратов . И подобных примеров может быть приведено очень много.
В медицине препараты на основе липосом пока не получили широкого распространения. И в такой области медицины, как дерматвенерология липосомы почти не представлены.
Эффективность воздействия липосом обусловлена их уникальными свойствами и возможностью проникновения в ткани. Таким путем может быть обеспечена не только доставка полезных для организма липидов, из которых состоит липосомальная мембрана, но и других веществ, транспортируемых липосомами.
Одной из основных проблем, связанных с фармацевтическими липосомальными препаратами, является их стабильность в условиях длительного хранения. Липосомы в виде водной дисперсии подвергаются гидролизу, имеют ограниченную стабильность, связанную с агрегацией, потерей активного компонента во внешнюю среду, химической деградацией активного компонента, возможным перекисным окислением липидов. В связи с этим в последнее время разрабатываются методы получения сухих порошкообразных препаратов на основе так называемой пролипосомальной технологии [22]. Под пролипосомами понимают вещества, которые при взаимодействии с водой самопроизвольно образуют липосомы. Данный метод позволяет решить две основные проблемы: получения стерильных пролипосомальных порошков и инкапсулирования активных компонентов непосредственно перед введением препаратов в организм. При использовании пролипосом в косметологии важным преимуществом является возможность самостоятельно подбирать и включать биологически-активные вещества в состав липосом. Они могут быть использованы так же и для стабилизации суспензий плохо растворимых в воде веществ, таких как кофеин, соевые флавоноиды, сухие экстракты и т.д [16,22].
В середине 60-х годов мало кто знал, что означает слово "липосомы". Теперь мы являемся свидетелями небывалого расцвета фактически новой науки и ее активного проникновения во многие сферы человеческой деятельности. Такая оценка не является результатом предвзятости или намеренного преувеличения имеющихся достижений. Скорее, наоборот, о реальных успехах этой науки долгое время знали только специалисты. И то, что мы видим сейчас, означает, что рождение этой области знаний было объективной необходимостью, когда зерна нового попадают на благодатную, подготовленную к их восприятию почву [3].
Используйте в уходе за кожей липосомальную косметику ОДРИ и ЛиДерМ:
- Крем противоугревой с липосомами ЛИПРО
- Крем антиаллергический с липосомами ЛИПЭК
- Крем для наружной терапии псориаза с липосомами ЛИПСОР
Список использованной литературы
- Биологическая эффективность липосомальной формы витамина D3 :автореферат. Н. Л. Хрестовая /Киев 1992 г./
- Биотехнология получения лекарственных и иммуногенных липосомальных композиций… Т. В. Таран /Ставрополь 2004 г./
- Васьковский В.В. Липиды // Соросовский Образовательный Журнал. 1997, № 3., с. 32-37.
- Изучение физико-химических свойств и стандартизация магнитоуправляемых липосом: автореферат. Г. К. Исмаилова /Пятигорск 2005 г./
- Каплун А. П, Ле Банг Шон, Краснопольский Ю. М., Швец В. И. Липосомы и другие наночастицы как средство доставки лекарственных веществ. /Государственная академия тонкой химической технологии им. М.В. Ломоносова, Москва.
- Кузякова Л.М. Разработка биотехнологий производства липосомальных фитопрепаратов для проблемной кожи. /Дерматокосметология. Ставрополь 2004 г./
- Кузякова Л.М., Носенко М.А. Изучение степени токсичности и собственной биологической активности липосомальных эмульсий // Материалы IV-oii международной научно-практической конференции «Здоровье и образование в XXI веке». - М., 2003. - С.358.
- Кузякова Л.М., Носенко М.А. Исследования фитокомплекса лекарственных трав для практической реализации в косметологии // Материалы международной научно-практической конференции «Биоресурсы, биотехнологии, инновации юга России».- Пятигорск, 2003.- С.249-252.
- Кузякова Л.М., Ефременко В.И.. Медикаментозное преодоление клеточных и анатомических барьеров с помощью липосом. Ставрополь, 2000 г.
- Кузякова Л.М., Носенко М.А. Изучение антимикробной активностии микробиологической чистоты препаратов на основе лекарственного растительного сырья// Материалы 59-й межрегиональной конференции по фармации и фармакологии: «Разработка, исследование и маркетинг новой фармацевтической продукции». - Пятигорск, 2004.- С.289-290.
- Кучма И.Ю., Волянский А.Ю., Москаленко В.Ф. и др. Применение фениламида цис-акотиновой кислоты в липосомальной форме для терапии герпеса // Журнал микробиологии.- 2000. - №5. - С, 58-61.
- Липосомы в биологических системах / Под ред. Г. Грегориадиса, А. Аллисона. М.: Медицина, 1983.
- Липосомы и их взаимодействие с клетками и тканями.// Материалы Всесоюзного симпозиума, Москва 1980 г./Наука 1981 г./
- Липосомы в медицине // Вестн. Акад. мед. наук. 1990. № 6, 8.
- Липосома с генной начинкой. // Nature Genetics. 1995. V.9. P.243-245. (Статья заимствована из nuweb.jinr.ru)
- Марголис Л.Б., Бергельсон Л.Д. Липосомы и их взаимодействие с клетками. М.: Наука, 1986.
- Маяцкая Т.В. Заключение по результатам изучения клинической эффективности "Геля бальзама репарирующего" производства ЗАО "МИРРА-М": Научный отчет. - М.: Институт красоты, 1999.
- Методологические подходы и разработка технологии липосомальных лекарственных и лечебно-профилактических препаратов: докторская диссертация. Л.М.Кузяковой/ г.Пятигорск, 2000 г.
- Несытова Н.Ю., Палева Н.С., Ильина Е.В., Шенк П., Бендас Ф., Нун П. Тенденции в развитии исследований в области липосом: Обзор патентной литературы // Вестник АМН СССР. - 1990.- С. 8-19.
- Носенко М.А. Экспериментальным подбор компонентов для конструирования лечебно-профилактических препаратов по уходу за проблемной кожей лица // Материалы межрегиональной конференции «Физиологические проблемы адаптации», посвященной 80-летию И.А Држевецкоп. - Ставрополь, 2003. - С. 117- I 19.
- Носенко М.А. Подбор реагентов для экстракции биологически активных веществ из лекарственных трав // Материалы IV-ой международной научно-практической конференции «Здоровье и образование в XXIвеке». - М„ 2003. - С.460-461.
- Носенко М.А. Совершенствование биотехнологии конструирования липосомальных лечебно-профилактических косметических средств //Материалы семинара-презентации инновационных научно-техническихпроектов «Биотехнология - 2003». - Пущино, 2003.- С.29-31.
- Носенко М.А. Комплексный подход к изучению эффективности лечебно-профилактических косметических средств для проблемной кожи// Материалы международной конференции «Современные достижения фундаментальных наук в решении актуальных проблем медицины».-Астрахань, 2004.-С. 204-206.
- Осто Марк Дж. Липосомы // В мире науки, -1987. - №3. - С.71-77.
- Посте Дж.Взаимодействие липидных везикул (липосом) с клетками в культуре и их использование как переносчиков лекарств и макромолекул, В кн.: Липосомы в биологических системах. - М.: Медицина, 1988. - С. 107-155.
- Потапов В.Д., Чубатова С.А., Левчук В.П. и др. Повышение эффективности действия бифидумбактерий путем обработки их липосомами, нагруженными иммуномодулятором // 5-я Всероссийская конф, "Научные основы технологии производства - ветеринарных препаратов". Щелково, 1996. - 297 с.
- Умнов А. В. Разработка и совершенствование биотехнологических процессов в производстве липосомальных косметических препаратов лечебно-профилактического назначения: Автореферат. /Ставрополь 2002 г./
- Рингсдорф Г., Шмидт Б. Системы полимерных носителей лекарств. /, Журнал Всесоюзного химического общества им. Д.И.Менделеева, 1987, Т. 32 № 5 с 487-501
- Умнов А.В., Носенко М.А. Разработка состава липосомальных фитопрепаратов для ухода за проблемной кожей// Материалы 58-й межрегиональнойконференции по фармации и фармакологии: «Разработка, исследование и маркетинг новой фармацевтической продукции». - Пятигорск, 2003.- С.162-164.
- Фаворова О.О. Лечение генами – фантастика или реальность? // Соросовский Образовательный Журнал. 1997. № 2. С. 21-27.
- Чазов Е.И., Смирнов В.Н., Торчилин В.П. Липосомы как средства направленного транспорта лекарств. / Журнал Всесоюзного химического общества им. Д.И.Менделеева, 1987, Т 32 № 5 с 502 – 513
- Чубатова С.А., Тульский B.C., Панюшин С.К., Кузнецова Г.В., Голубков А.С. Возможности оригинальной технологии микрокапсулирования биологически активных веществ //International Jornal on Immunorehabilitation. - 1999. - №12, -S.12.
- Цыганенко А. Я., Благой Ю. П. Эффективность липосомального рифампицина при экспериментальной стафилококковой инфекции. / Харьков: ФТИНТ 1986 г. с. 41/
- Bangham A.D., Horne R.W. Negative Staining of Phospholipids and their Structured Modification by Surface Agents as Observed in the Electron Microscope // J. Mol. Biol. 1964. Vol. 8. P. 660-668.
- Bangham A.D., Standish M.M., Watkins J.C. Diffusion of Univalent Ions Across the Lamelae of Swollen Phospholipids // Ibid. 1965. Vol. 13. P. 238-252.
- Lasic D.D. Liposomes: From Physics to Applications. Amsterdam: Elsevier, 1993.
- Shigeta Y.,Imanaka H. Местное применение липосомной линолевой кислоты: усиление продолжительности эффекта в эпидермисе. / J.Liposome Res 2003 .№1,с.85
- Xu Yue-Hong, Xu Lian-Ying. Сравнительное исследование липосомного геля и обычного геля интергерримина. / Chin. J. Natur. Med 2003 г. 1,№4 с.210-212

